〇医薬品の製剤
原薬(薬物)→製剤→投与→作用
原薬はそのままでヒトに投与されることはありません。必ず、製剤という形にして投与されます。製剤には、投与されやすい形、状態にし、投与後予期したように効果が発現し、副作用の発現が抑えられるようにコントロールする機能を求めています。逆の言い方をすれば、製剤によって、原薬の有する作用、効果は自由に調節することが可能であり、また、意図しない方向に変化する可能性もあり得るということです。ジェネリック医薬品は先発医薬品と異なるメーカーで製造されます。メーカーが異なるとは、即ち、製剤が異なるということです。用いる添加物、用いる製剤化の方法や技術、製剤機器が異なります。そのため、製剤が異なっていても、臨床上の有効性、安全性を変化させうる因子は先発品と同一になるように作られていることを確認することが行われます。異なる結果を生み出す可能性のある部分で、同一であることが実証できれば、その結果現れる臨床上の有効性、安全性は例外なく同一となることから、それらの項目が実証されればそれで十分です。この実証しないといけない項目が生物学的同等性です。ちなみに、この考え方は、先発医薬品の多くの剤形変更体の開発においても同じです。
〇生物学的同等性試験の考え方
全身適用(注意1)、局所適用(注意2)の両者ともに、医薬品の効果、作用は作用を示す部位での薬物の濃度に関連付けられます。そのため、同じ成分を含む医薬品が二つあった場合、作用を示す部位での薬物濃度(遊離薬物濃度)が重なっていれば、有効性、安全性は例外なく二つの医薬品は同じであると結論できます。この原理を利用して、先発医薬品とジェネリック医薬品の臨床上の効果、作用が同じであることを確認しています。この目的のための試験を生物学的同等性試験と呼びます。
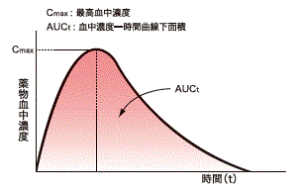
全身適用を目的とする医薬品では、成分が必ず全身循環を通って作用を示す部位に行きますので、全身循環血中の薬物濃度が重なっていれば、医薬品の効果と作用は同じであると結論することができます。具体的には、薬物の血中濃度の時間推移を測定し、その最高濃度(Cmax)と血中濃度-時間曲線下の面積(AUC)が同じであることにより、血中濃度の重なりを確認しています。
局所適用を目的とする医薬品では、作用を示す部位での薬物濃度あるいはそれに替わる部位における濃度が測定できれば、その値が重なっていることを示すことになります。局所皮膚適用製剤で、作用を示す部位が皮膚の角層あるいはそれより深部にある場合には、角層中薬物濃度を測定し、それがほとんど同じで重なっている場合に、生物学的同等性が成り立っていると評価します。
全身適用、局所適用に共通して、作用を示す部位あるいはそれに替わる部位での薬物濃度の測定が不可能である場合、あるいはその濃度が臨床効果、作用と関連が明らかでない場合には、薬物が引き起こす効果や作用を比較し、両者間に差異がないことを示します。
ちなみに、直接血液内に投与される注射剤は、作用を示す部位の薬物濃度が必ず重なるため、生物学的同等性試験は必要ではなりません。
注意1:投与した医薬品から成分が一旦全身循環血中に入り、全身循環血の流れによって作用を示す部位に運ばれ作用、効果を現す医薬品。例として、錠剤、散剤、一部の貼り薬や坐剤、注射薬等があります。
注意2:全身循環血の流れによって成分が作用を示す部位に運ばれるのではなく、投与された部位から直接に作用を示す部位に到達し、作用、効果を現す医薬品。例して、一部の坐剤、軟膏、クリーム、剤等があります。
生物学的同等性の評価は、ヒトを対象に行うことになっています。ヒトを対象とする以外の方法で生物学的同等性を評価できないか、その代替試験法が多く検討されてきましたが、残念ながら、見出されていません。現在は、必ず、ヒトを対象とした試験で生物学的同等性は確認することとなっています。
〇生物学的同等性試験の内容
全身適用の医薬品を例にします。薬物を投与したのち血中濃度の時間推移を測定し、その最高濃度(Cmax)と血中濃度-時間曲線下の免責(AUC)が同じであることにより、血中濃度の重なりを確認しています。ジェネリック医薬品の示すCmax、AUCの平均値が先発医薬品のそれぞれの平均値の80%から125%の範囲にあることを同等とする条件としています。この幅で臨床上の効果と作用は十分確保できます(ちなみに、この考え方は、先発医薬品の多くの剤形変更体の開発においても同じです。また、医療者からも添加物やコーティングの違いを心配する意見がありますが、その回答の一つがこれです)。また、ヒトによって血中濃度は変動し、平均値も変動します。そこで、確率論から、100回の内90回以上が範囲内に入っていることが示された場合に同等であるとし、非同等な医薬品を同等とする見誤りの危険性を5%以下に抑えた判定方法となっています。臨床上の効果、作用が同等であることを直接に効果、作用を指標に実証しようとすると、そのばらつきが大きいことから三桁から四桁の被験者数が必要と推定されますが、薬物血中濃度のばらつきは相対的に小さく、本質的な差が±20%というわずかな値であっても、その差を検出するのにわずか20~30名程度の被験者で一般的には可能となります。だから、生物学的同等性試験は通常、20から40名程度の被験者を対象に行われます。非常に制度が高く効率の良い試験です。
しかし、血中濃度に個体間の違いが出ることは確かです。その為、先発医薬品とジェネリック医薬品の間での血中濃度を比較するときに、両医薬品とも同じ被験者に飲んでもらい、そのとき得られる血中濃度を比較すれば、同じ薬物量が体内に入ったとしても血中濃度が異なるという複雑性は解消され、比較できます。同じ被験者に比較しようとする両医薬品とも飲んでもらう試験方法を交差試験(クロスオーバー)と呼びます。生物学的同等性試験はこのような背景で、科学的に正確に評価しています。異なる被験者に先発医薬品とジェネリック医薬品を服用してもらい、それぞれの血中濃度だけを集めて平均値を示しても、両医薬品間で同等であったとしても、その平均値は大きく異なることは良く見受けられます。医薬品の添付文書をみるとき、あるメーカーが測定したCmaxやAUCと、他のメーカーが測定したその値を比較しても同等であるかどうかわかりません。それは被験者が異なった条件で行われているからです。必ず同一被験者に投与した両医薬品のCmaxやAUCの値を同時に比較して示されていなければ同等性は推定できません。また、生物学的同等性の結果をもとに、厚生労働省から製造販売の承認をとっているわけだから、元々、同等でないデータが存在するはずはありません。
生物学的同等性試験のポイント
①健常成人志願者
②先発医薬品(対象製剤)と後発医薬品(試験製剤)
③2群の交差試験
④空腹時投与
⑤未変化体あるいは活性代謝物の血中濃度(尿中排泄速度)の時間推移
⑥Cmax、AUC
⑦後発医薬品の平均値が先発医薬品のそれの80%から125%の範囲にある
⑧90%信頼区間によって示す